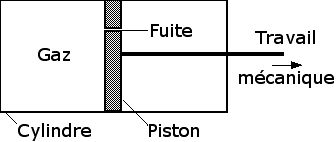
 À ce stade, le lecteur peut se demander pourquoi j’ai consacré trois articles à parler de thermodynamique sur un site politique. C’est que les lois de la thermodynamique ne s’appliquent pas seulement aux gaz mais à tous les phénomènes physiques y compris —comme nous allons le voir— à la vie, c’est-à-dire à nous-mêmes. Peut-être le lecteur a-t’il déjà remarqué que les deux concepts clés de la thermodynamique, <i>énergie</i> et <i>information</i> sont à la base même des révolutions que traverse l’humanité. Après la révolution industrielle liée à l’utilisation de <i>l’énergie</i>, l’humanité est en train de traverser une nouvelle révolution liée à l’utilisation de <i>l’information</i>.
À ce stade, le lecteur peut se demander pourquoi j’ai consacré trois articles à parler de thermodynamique sur un site politique. C’est que les lois de la thermodynamique ne s’appliquent pas seulement aux gaz mais à tous les phénomènes physiques y compris —comme nous allons le voir— à la vie, c’est-à-dire à nous-mêmes. Peut-être le lecteur a-t’il déjà remarqué que les deux concepts clés de la thermodynamique, <i>énergie</i> et <i>information</i> sont à la base même des révolutions que traverse l’humanité. Après la révolution industrielle liée à l’utilisation de <i>l’énergie</i>, l’humanité est en train de traverser une nouvelle révolution liée à l’utilisation de <i>l’information</i>.
Il fallait-il sans doute s’y attendre. La révolution néolithique n’a-t’elle pas été elle aussi suivie d’une révolution de l’information avec l’invention de l’écriture et de la monnaie? C’est en effet le besoin de comptabiliser les échanges commerciaux qui a donné naissance à ces inventions. La monnaie elle-même peut être considérée comme une mesure d’entropie ou plutôt de son opposé appelé <i>néguentropie</i> (ou entropie négative). Le rôle de la monnaie est de maintenir la <i>réversibilité</i> des échanges. Tout ce qui se dégrade, perd de la valeur monétaire (son entropie augmente). Inversement une chose précieuse est généralement une chose rare donc de faible entropie. C’est ainsi que le prix du pétrole augmente lorsque la probabilité d’en trouver diminue (1).
Nous assistons actuellement à une frénésie d’échanges d’information à laquelle vous participez vous-même en lisant ce blog. Chaque jour, une quantité croissante d’information (la monnaie en est un cas particulier) traverse le globe à la vitesse de la lumière. Suivant toujours la loi de Moore <a href= »http://fr.wikipedia.org/wiki/Loi_de_Moore »>(2)</a>, la capacité d’enregistrement des mémoires électroniques double tous les deux ans. Pourquoi cette frénésie? Elle est d’autant plus surprenante que tout accroissement de l’information correspond à une diminution d’entropie ce qui parait contraire au second principe de la thermodynamique. Nous allons voir que, loin d’être contraire au second principe, cette frénésie y est directement apparentée.
Il nous faut d’abord remarquer que le second principe n’interdit à l’entropie de diminuer que dans un système <i>isolé</i> c’est-à-dire sans apport d’énergie. Si vous mettez des glaçons et de l’eau chaude dans une bouteille Thermos, vous obtenez de l’eau froide. C’est une transformation irréversible durant laquelle l’entropie augmente. Si vous y mettez de l’eau froide vous ne verrez jamais apparaître des glaçons et de l’eau chaude. L’entropie ne pourra pas diminuer. Par contre, si vous mettez de l’eau froide dans votre réfrigérateur et que <i>vous le branchez sur une prise électrique</i>, vous verrez apparaître des glaçons à l’intérieur et un dégagement de chaleur à l’extérieur (en général par derrière). L’entropie a diminué provisoirement grâce à un apport <i>extérieur</i> d’énergie électrique. Ce n’est que provisoire car la chaleur produite derrière votre réfrigérateur va se dissiper dans l’atmosphère et vos glaçons vont fondre dans votre boisson achevant de dissiper toute l’énergie électrique que vous avez consommée. Au total, l’entropie aura définitivement augmenté.
Il nous reste maintenant à comprendre pourquoi nous fabriquons tant de réfrigérateurs et autres machines thermiques. Une réponse étonnante est que c’est la conséquence d’un principe encore plus général que le second principe, appelé principe de production maximale d’entropie (Maximum Entropy Production ou MEP) <a href= »http://www.entropylaw.com/entropyproduction.html »>(3)</a>. Ce principe n’a été établi qu’assez récemment, plus d’un siècle après Boltzmann, grâce à l’étude des systèmes thermodynamiques hors équilibre. Il stipule que l’univers évolue de façon à <i>maximiser son taux de production d’entropie </i>(4). Nous commençons seulement à en réaliser l’étendue des conséquences. Il explique en particulier la vie, donc nous-mêmes et par exemple le fait que, grâce à l’invention du réfrigérateur, nous consommons davantage d’électricité donc <i>nous dissipons davantage d’énergie ou nous produisons davantage d’entropie</i> que nous ne le faisions autrefois.
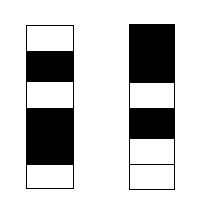
Après les travaux de Boltzmann, l’entropie a d’abord été considérée comme une mesure du désordre. Si on met en vrac des pions blancs et des pions noirs dans une même boîte on dit qu’ils sont en désordre. Si on les sépare dans deux boites différentes on dit qu’on met de l’ordre. Il en est de même pour les molécules. Si on mélange deux gaz différents, l’opération est irréversible et l’entropie augmente. Cette augmentation d’entropie correspond bien au passage d’un état ordonné vers un état désordonné. Notons que la notion d’ordre est liée à celle d’information. Vous pouvez soit ranger vos outils en mettant de l’ordre soit les laisser en désordre et <i>mémoriser l’information </i>sur leur emplacement. Si vous perdez cette information l’entropie augmentera et il vous faudra dépenser de l’énergie pour les retrouver.
<br /><br />
<table width= »450″ >
<tr align= »center »>
<td width= »225″>
<img src= »ordre.jpg » alt= »ordre »/>
</td>
<td width= »225″>
<img src= »desordre.jpg » alt= »ordre » />
</td>
</tr>
<tr align= »center »>
<td width= »225″>
Ordre = entropie faible
</td>
<td width= »225″>
Désordre = entropie élevée
</td>
</tr>
</table>
<br />
La thermodynamique classique de Clausius et de Boltzmann explique très bien le comportement des systèmes à l’équilibre (qui n’évoluent pas) ou très proches de l’équilibre (qui évoluent lentement de façon quasi-réversible). Dans ce cas on observe toujours une tendance vers le désordre. Lorsque deux pièces mécaniques frottent l’une contre l’autre, le mouvement mécanique ordonné des molécules se transforme en un mouvement désordonné qui se manifeste par une élévation de la température. Malheureusement, la thermodynamique classique n’explique pas que lorsqu’on crée un déséquilibre important dans un fluide, il peut y avoir apparition spontannée de mouvements <i>ordonnés</i>.
Les exemples classiques en sont le mouvement convectif de l’eau dans une casserole que l’on met sur le feu, l’apparition de tourbillons dans le sillage d’une voiture, la houle sur l’océan, les cyclones dans l’atmosphère, etc… La thermodynamique classique s’applique mal à ces systèmes car ce ne sont pas des systèmes isolés. Ce sont des systèmes dits ouverts qui sont traversés par des flux importants d’énergie. Le second principe ne s’applique alors qu’à l’entropie totale de l’univers considéré comme système isolé. Cette entropie est la somme de l’entropie du système et de celle du milieu extérieur. De tels systèmes peuvent exister parce que la diminution d’entropie interne au système liée à la création d’ordre est largement compensée par la forte augmentation d’entropie de son environnement. Ces phénomènes ne sont donc pas en contradiction avec le second principe, mais la thermodynamique classique ne les prévoit pas.
Dans nos prochains articles nous verrons comment le principe de production maximale d’entropie explique l’apparition spontannée d’ordre, y compris l’apparition de la vie, et pourquoi l’évolution nous pousse à consommer toujours davantage d’énergie.
(1) Sur la monnaie en tant que mesure d’entropie voir:
Valery Chalidze, Entropy Demystified, Potential Order, Life and Money (Universal Publishers, 2000).
Nicholas Georgescu-Roegen, The Entropy Law and the Economic Process (iUniverse, 1999).
(2) Voir: http://fr.wikipedia.org/wiki/Loi_de_Moore
(3) Voir: http://www.entropylaw.com/entropyproduction.html
(4) Le principe de production maximale d’entropie est en fait un théorème de mécanique statistique: Dewar, R.C., Maximum entropy production and the fluctuation theorem, J. Phys. A: Math. Gen. 38 (2005) L371-L381.